Флуоресцентний резонансний перенос енергії (FRET)
Флуоресцентний резонансний перенос енергії (FRET) — це процес безвипромінювального переносу енергії, в якому енергія збудженого стану донора переноситься в збуджений стан акцептора через взаємодію міжмолекулярних електричних пар.Цей процес не включає фотони і тому не є радіаційним.Цей аналіз має такі переваги, як швидкий, чутливий і простий.
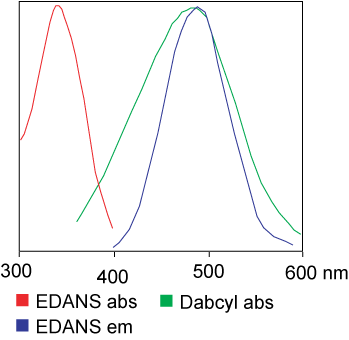
Барвник, який використовується в аналізі FRET, може бути ідентичним.Але в більшості застосувань насправді використовуються різні барвники.Коротко кажучи, передача енергії світлового резонансу — це передача пари диполів від донора (барвник 1) до акцептора (барвник 2), коли донорна група збуджена.Загалом, спектр випромінювання донорної флуорофорної групи перекривається зі спектром поглинання акцепторної групи.«Коли відстань між двома флуорофорами відповідна (10-100 А), можна спостерігати передачу енергії флуорофора від донора до акцептора».Спосіб передачі енергії залежить від хімічної структури рецептора:
1. Перетворюється на молекулярну вібрацію, тобто світлове світло передачі енергії зникає.(Рецептор - світлогасник)
2. Випромінювання є більш інтенсивним, ніж сам рецептор, що призводить до червоного зсуву у вторинному спектрі флуоресценції».(Рецептори — випромінювачі світла).
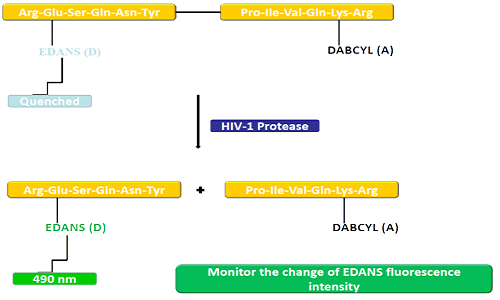
Донорна група (EDANS) і акцепторний ген (DABCYL) рівномірно пов’язані з природним субстратом протеази ВІЛ, і коли субстрат не від’єднано, DABCYL може гасити EDANS, а потім стає невизначуваним для фтору.Після відключення протеази ВІЛ-1 EDANS більше не гаситься DABCYL, і згодом можна виявити люциферази EDANS.Доступність інгібіторів протеази можна контролювати за змінами інтенсивності флуоресценції EDANS.
Пептиди FRET є зручними інструментами для дослідження неспецифічності пептидаз.Оскільки його реакційний процес можна постійно контролювати, він забезпечує зручний метод виявлення активності ферменту.Блиск, який утворюється після гідролізу пептидних зв’язків донором/акцептором, забезпечує міру активності ферменту при наномолярних концентраціях.Коли пептид FRET неушкоджений, він демонструє раптове зникнення внутрішнього спалаху, але коли будь-який пептидний зв’язок навпроти донора/акцептора розривається, він вивільняє спалах, який можна постійно виявляти, а потім можна кількісно визначити активність ферменту.
Час публікації: 14 серпня 2023 р