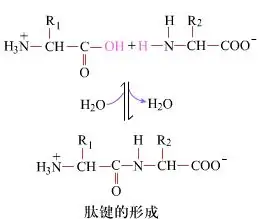
На поверхні утворення пептидних зв’язків з утворенням дипептидів є простим хімічним процесом.Це означає, що два амінокислотні компоненти з’єднані пептидним зв’язком, амідним зв’язком, під час дегідратації.
Утворення пептидного зв’язку – це активація амінокислоти в м’яких умовах реакції.(A) карбоксильна частина, друга амінокислота (B) Нуклеофільна активована карбоксильна частина потім утворює дипептид (AB).«Якщо карбоксильний компонент (А) не захищений, утворення пептидного зв’язку неможливо контролювати».Побічні продукти, такі як лінійні та циклічні пептиди, можуть бути змішані з цільовими сполуками АВ.Отже, усі функціональні групи, які не беруть участі в утворенні пептидного зв’язку, повинні бути захищені тимчасово оборотним чином під час синтезу пептиду.
Отже, синтез пептидів — утворення кожного пептидного зв’язку — включає три етапи агрегації.
Перший крок полягає в тому, щоб підготувати деякі амінокислоти, які потребують захисту, а цвіттеріонна структура амінокислот більше не існує.
Другий етап — це двостадійна реакція з утворенням пептидних зв’язків, у якій карбоксильна група N-захищеної амінокислоти спочатку активується до активного проміжного продукту, а потім утворюється пептидний зв’язок.Ця пов’язана реакція може відбуватися або як одноетапна, або як дві послідовні реакції.
Третій крок - вибіркове видалення або повне видалення захисної основи.Хоча все видалення може відбутися лише після того, як усі пептидні ланцюги були зібрані, селективне видалення захисних груп також необхідне для продовження синтезу пептидів.
Оскільки 10 амінокислот (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec і Cys) містять функціональні групи бічних ланцюгів, які вимагають селективного захисту, що ускладнює синтез пептидів.Необхідно розрізняти тимчасові та напівпостійні бази захисту через різні вимоги до вибірковості.Тимчасові захисні групи використовуються на наступному етапі для відображення тимчасового захисту амінокислотних або карбоксильних функціональних груп.Напівпостійні захисні групи видаляються без втручання у вже сформовані пептидні зв’язки або бічні ланцюги амінокислот, іноді під час синтезу.
«В ідеалі активація карбоксильного компонента та подальше утворення пептидних зв’язків (реакції сполучення) мають бути швидкими, без утворення рацемічних або побічних продуктів, а для досягнення високих виходів слід застосовувати молярні реагенти».На жаль, жоден із методів хімічного сполучення не задовольняє цим вимогам, і лише деякі з них придатні для практичного синтезу.
Під час синтезу пептидів функціональні групи, що беруть участь у різних реакціях, зазвичай пов’язані з мануальним центром, єдиним винятком є гліцин, і існує потенційний ризик обертання.
Останнім етапом циклу синтезу пептидів є видалення всіх захисних груп.Селективне видалення захисних груп є важливим для подовження пептидного ланцюга на додаток до вимоги повного видалення захисту при синтезі дипептиду.Синтетичні стратегії слід ретельно планувати.Залежно від стратегічного вибору N може вибірково видаляти α-аміно- або карбоксильні захисні групи.Термін «стратегія» відноситься до послідовності реакцій конденсації окремих амінокислот.Загалом існує різниця між поступовим синтезом і конденсацією фрагментів.Синтез пептидів (також відомий як «звичайний синтез») відбувається в розчині.У більшості випадків поступове подовження пептидного ланцюга може бути синтезовано лише шляхом використання пептидного ланцюга для синтезу коротших фрагментів.Щоб синтезувати довші пептиди, цільові молекули необхідно сегментувати на відповідні фрагменти та визначити, що вони можуть мінімізувати ступінь диференціювання на С-кінці.Після того, як окремі фрагменти будуть поступово зібрані, цільове з’єднання буде з’єднано.Стратегія пептидного синтезу включає вибір найкращого і найбільш відповідного захисного фрагмента, а стратегія пептидного синтезу включає вибір найбільш відповідної комбінації захисних основ і найкращого методу кон'югації фрагмента.
Час публікації: 19 липня 2023 р