Відповідно до способу з’єднання амінокислоти та цукру цукровий пептид можна розділити на чотири категорії: O-глікозилювання, C-N-глікозилювання, оцукрювання роси та з’єднання GPI (глікофосфатидіінозитол).
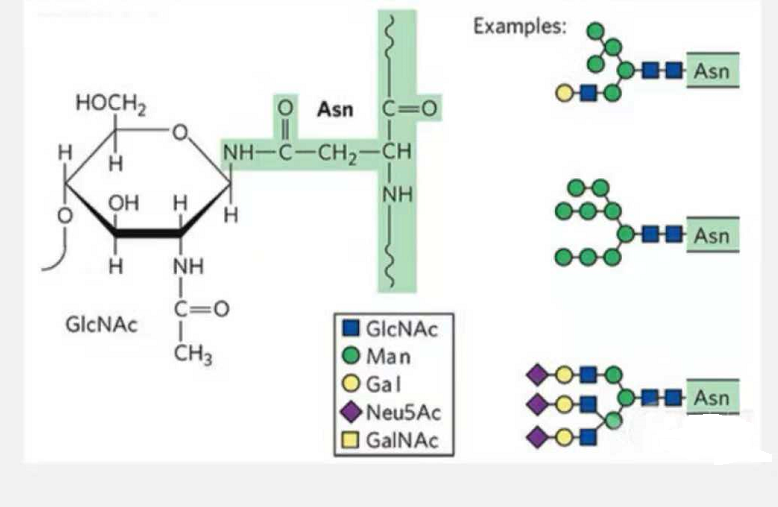
1. Глікопептиди N-глікозилювання складаються з N-ацетамід глюкози на відновлюючому кінці гліканового ланцюга (Glc-Nac), пов’язаного з атомом N на амідній групі бічного ланцюга деяких Asn у пептидному ланцюзі, і Asn здатні зв'язувати глікановий ланцюг, повинні бути розташовані в AsN-X-Ser /Thr (X! =P) у мотиві, утвореному залишками.Цукор - N-ацетилглюкозамін.
Модифікований N-глікозилюванням структурний глікопептид
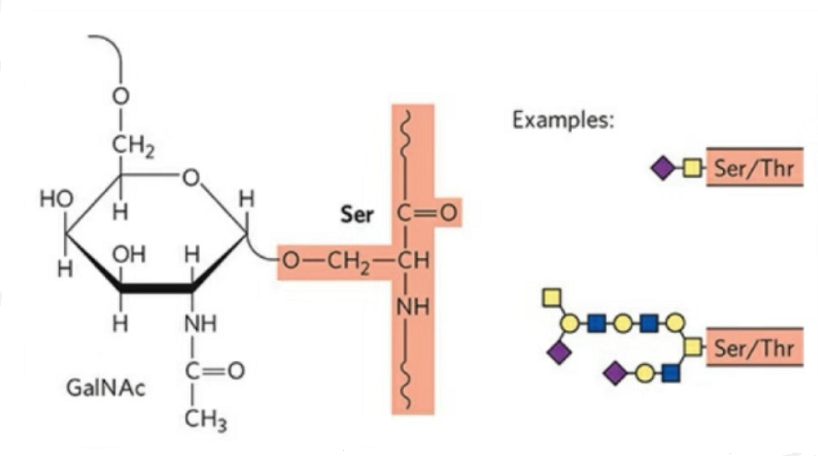
2. Структура О-глікозилювання простіша за N-глікозилювання.Цей глікопептид, як правило, коротший за глікан, але має більше типів, ніж N-глікозилювання.Ser і Thr, як правило, можуть бути глікозильовані в пептидному ланцюзі.Крім того, існують глікопептиди, оформлені тирозиновим, гідроксильним і гідроксипроліновим глікозилюванням.Положенням зв’язку є гідроксильний атом кисню на бічному ланцюзі залишку.Зв’язаними цукрами є галактоза або N-ацетилгалактозамін (Gal&GalNAc), або глюкоза/глюкозамін (Glc/GlcNAc), маноза/маннозамін (Man/ManNAc) тощо.
О-глікозилювання змінює структуру
3. Глікозилювання глікопептиду O-GlcNAC ((N-ацетилцистеїн (NAC)) (glcnAcN-ацетилглюкозамін/ацетилглюкозамін)
Одне глікозилювання N-ацетилглюкозаміну (GlcNAc) з’єднує білки O-GlcNAc з гідроксильним атомом кисню залишку серину або треоніну білка.Глікозилювання O-GlcNA є моносахаридним орнаментом O-GlcNAc без розширення глікану;Подібно до фосфорилювання пептидів, глікозилювання O-GlcNAc глікопептидів також є динамічним процесом декорування білка.Аномальна прикраса O-GlcNAc може спричинити різноманітні захворювання, такі як діабет, серцево-судинні захворювання, пухлини, хвороба Альцгеймера тощо.
Точки глікозилювання глікопептидів
Основні структури поліпептидних і цукрових ланцюгів пов’язані з білковими ланцюгами ковалентними зв’язками, а сайти, що з’єднують цукрові ланцюги, називаються сайтами глікозилювання.Оскільки немає матриці для відстеження біосинтезу глікопептидних цукрових ланцюгів, різні цукрові ланцюги будуть приєднані до одного сайту глікозилювання, що призводить до так званої мікроскопічної неоднорідності.
Глікозилювання глікопептидів
1. Вплив глікозилювання глікопептиду на терапію - ефективність терапевтичних білків
У випадку терапевтичних білків глікозилювання також впливає на період напіввиведення та націлювання білкових препаратів in vivo
2. Глікозилювання розчинних глікопептидів і білків
Дослідження показали, що цукрові ланцюги на поверхні білків можуть покращити молекулярну розчинність білків
3. Глікозилювання глікопептидів та імуногенність білка
З одного боку, цукрові ланцюжки на поверхні білків можуть індукувати специфічні імунні відповіді.З іншого боку, цукрові ланцюги можуть покривати певні поверхні на поверхні білка і знижувати його імуногенність
4. Глікозилювання глікопептиду, що підвищує стабільність білка
Глікозилювання може збільшити стійкість білків до різних умов денатурації (таких як денатуранти, тепло тощо) і уникнути агрегації білків.У той же час цукрові ланцюги на поверхні білків також можуть покривати деякі точки протеолітичної деградації білкових молекул, тим самим підвищуючи стійкість білків до протеїназ
5. Глікозилювання глікопептидів, що впливає на біологічну активність білкових молекул
Зміна глікозилювання білка також може дозволити білковим молекулам формувати нові біологічні активності
Час публікації: 3 серпня 2023 р